باتری روی هوا (Zinc–air battery) یکی از انواع باتریهای فلز-هوا است که انرژی لازم را، به واسطه واکنش اکسیداسیون روی در اثر تماس با اکسیژن هوا، تامین میکند.
چگالی انرژی این باتریها بالا بوده و تولید آنها هزینه نسبتا کمی دارد. سل این نوع باتریها، کوچک بوده و اندازه آنها طوری است که میتوان آنها را در سمعکها قرار داد. این باتریها دارای ابعاد بزرگتری نیز هستند که برای دوربینهای فیلمبرداری مناسب هستند. این باتریها، مهمترین باتریهایی هستند که در پیشرانه خودروها مورد استفاده قرار گرفتهاند. همچنین آنها میتوانند میزان مورد نیازی از انرژی را ذخیره کنند.
نگاهی به تاریخچه باتری روی هوا (Zinc–air battery)
در قرن نوزدهم، به واسطه جذب شدن اکسیژن اتمسفر به یک جمعکننده جریان در کاتد کربنی، توسط باتریهای سل مرطوب Leclanche، اثر اکسیژن شناخته شد. در سال ۱۸۷۸، با اختراع یک الکترود متخلخل هوا-کربن پلاتینه، این امکان به وجود آمد که از آن در سل لبلانک، مانند دیاکسید منگنز، استفاده شود.
در سال ۱۹۳۲، George W.Heise و Erwin A. Schumacher ساخت محصولات تجاری به این شیوه را، با ساخت چندین سل، شروع کردند. در این سلها، از الکترودهای کربن به همراه موم، برای جلوگیری از جریان سیال، استفاده میشده است.
این نوع طراحیها، همچنان نیز برای سلهای بزرگ در باتری روی هوا، جهت تسهیل ناوبری و حمل و نقل ریلی، به کار گرفته میشوند.
البته لازم به ذکر است که امروزه ظرفیت باتریها کم بوده و حجم سلولها افزایش یافته است. سرعت عمل سلهای قدیمی، بسیار کمتر بوده است. در دهه ۱۹۷۰، الکترودهای نازکی، طبق تحقیقات سل سوختی، تولید شدند که نسل جدید سل روی-هوا را برای استفاده در وسایلی مانند سمعکها و دستگاههای پزشکی بهبود بخشیدند.
نگاهی به فناوری باتری روی هوا و موارد کاربرد آن
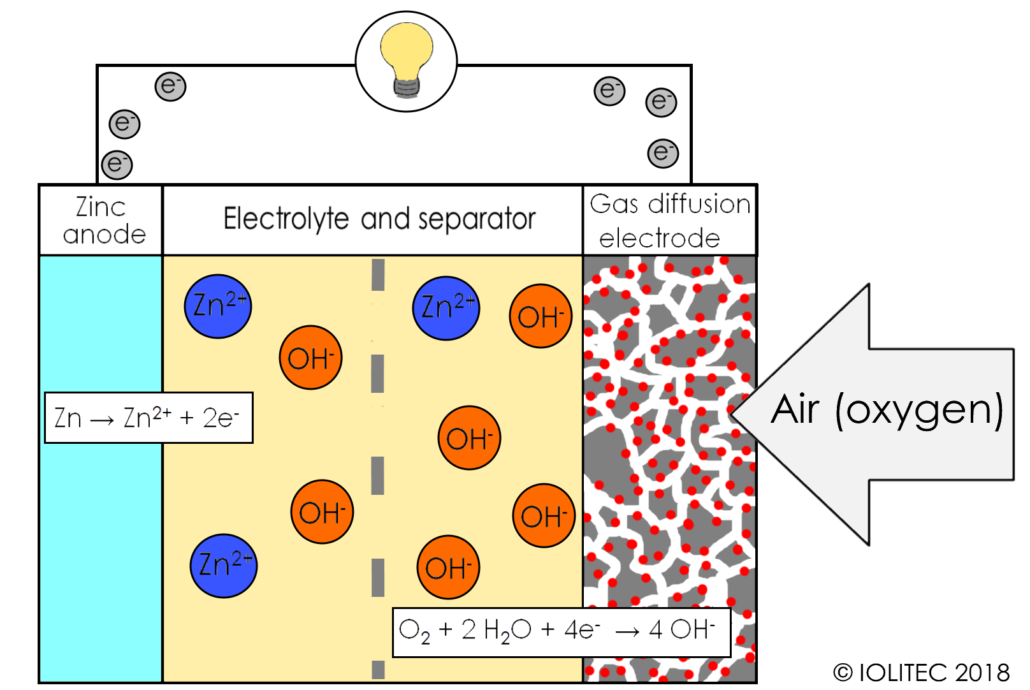
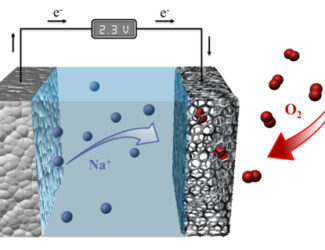
در این نوع باتری ها، توده ذرات روی در هنگام تخلیه، باعث تشکیل آند متخلخل اشباع شده با یک الکترولیت میشود. واکنش اکسیژن هوا در کاتد، باعث تشکیل شدن یونهای هیدروکسیل شده و به درون خمیر روی، منتقل میشوند و در نتیجه یون زینکات با فرمول شیمیایی Zn(OH)42- تشکیل میشود. این عمل موجب آزادسازی الکترونها برای حرکت به کاتد میشود.
یون زینکات به اکسید روی تبدیل شده و آب نیز به مایع الکترولیت بازگردانده میشود. آب و هیدروکسیل آند در کاتد بازیافت شده و بدین ترتیب، میزان آب مصرفی به صفر میرسد. از لحاظ نظری، ولتاژ این واکنشها، ۱٫۶۵ ولت است که البته در واقعیت، کاهش مقداری در حدود ۱٫۳۵ تا ۱٫۴۰ ولت را تجربه خواهد کرد.
برخی از ویژگیهای سلولهای سوختی و باتریها نیز در باتری روی هوا وجود دارند. روی سوختی است که با تغییر جریان هوا، میتوان میزان واکنش آن را کنترل کرده و خمیر تازه را با روی/الکترولیت اکسید شده جایگزین کرد.
جهت جایگزین کردن باتریهای ۱٫۳۵ ولت جیوهای منسوخ شده، میتوان از این باتریها استفاده نمود. این باتریهای منسوخ شده معمولا در سالهای ۱۹۷۰ تا ۱۹۸۰، در دوربینهای عکاسی و سمعک بکار میرفتهاند. همچنین، میتوان از این باتریها به عنوان باتری وسیله نقلیه الکتریکی و سیستم ذخیره انرژی در تاسیسات نیز استفاده کرد.
فرمول های واکنش های شیمیایی در یک باتری روی هوا
سلول روی-هوا شامل چندین فرمول شیمیایی میباشند که عبارتند از:
واکنش در آند:
Zn + 4OH− → Zn (OH) 42− + ۲e− (E0 = -۱٫۲۵ V)
واکنش مایعات:
Zn (OH) 42− → ZnO + H2O + 2OH−
واکنش در کاتد:
۲/۱ O2+ H2O + 2e− → ۲OH− (E0 = 0.34 V pH = ۱۱)
واکنش کلی در باتری روی هوا:
۲Zn + O2 → ۲ZnO E0= 1.59 ولت))
از آنجایی که ورود مقداری هوا به باتری روی هوا لازم است، نمیتوان آنها را به صورت آببندی شده، در یک محفظه نگهدارنده باتری، به کار برد. برای ظرفیتی به میزان یک آمپر بر ساعت، اکسیژنی به اندازه یک لیتر در هوا نیاز است.
ظرفیت ذخیره سازی و عمر مفید
سلهای روی-هوایی که برای دور ماندن از تماس با هوا آببندی شدهاند، ماندگاری بسیار بالایی دارند. در صورت برداشته نشدن مهر موم این سلها، میتوان سلهای ریز را تا ۳ سال در دمای اتاق، نگهداری کرد. البته بدین شکل، مقدار بسیاری کمی از ظرفیت باتری روی هوا، نابود میشود.
ماندگاری سلهای صنعتی در حالت خشک، نامحدود است. عمر کاربری یک سل روی-هوا در این باتریها، تابعی از تعامل آن با محیط است. الکترولیتها، در شرایط دمایی بالا و رطوبت پایین، آب را با سرعت بالاتری از دست میدهند؛ به این دلیل که الکترولیت همان هیدروکسید پتاسیم میباشد، وجود رطوبت زیاد در محیط باعث تجمع آب اضافی در سلول شده و در نتیجه کاتدها کدرتر شده و خصوصیات فعال آن از بین میرود.
به علاوه، هیدروکسید پتاسیم میتواند با دی اکسید کربن اتمسفر واکنش دهد. تشکیل کربنات باعث کاهش رسانایی الکترولیت میشود. سلهای ریز، با رها شدن در هوا، قابلیت تخلیه شدن خودکار پیدا میکنند. ظرفیت سلول معمولا به شکلی است که بتواند در طول چند هفته مورد استفاده قرار گیرد.
کاربرد باتری روی هوا در پیشرانه خودرو
فلز روی را میتوان به عنوان جایگزینی برای سوخت وسایل نقلیه و همچنین در ساخت باتری روی هوا، جهت تولید هیدروژن در محل یک پروژه کاربردی، استفاده کرد. خصوصیات روی به عنوان منبع انرژی برای وسایل نقلیه الکتریکی، توجهات را بر روی آن افزایش داده است.
از مزایای استفاده از باتری روی هوا در پیشرانه خودروها، میتوان به ۱۰۰ برابری بودن حجم منبع فلز روی در پوسته زمین نسبت به لیتیوم اشاره کرد. نرخ تولید سالانه جهانی فلز روی جهت تولید باتری روی هوا، قادر به تامین انرژی بیش از یک میلیارد وسیله نقلیه الکتریکی است؛ در حال حاضر تولید لیتیوم، برای تولید ده میلیون دستگاه مبتنی بر باتریهای یون لیتیومی کافی است.
باتری روی هوا را میتوان اصلیترین رقیب باتریهای یون-لیتیومی دانست. برای تولید این باتریها، معمولا کاتالیزورهای گران قیمتی مانند پلاتین یا اکسید ایریدیوم، به کار میرود؛ به همین دلیل قیمت این باتریها تقریبا گرانتر است.
محققان در حال بررسی بر روی افزایش کارآیی انواع باتری روی هوا هستند که با سایر کاتالیزگرها تولید میشوند. به همین منظور میتوان برخی از اکسیدهای فلزی را به کار گرفت که معمولا اکسیدهای آهن، کبالت یا نیکل را پیشنهاد میکنند، البته باید سمی بودن این فلزات را نیز در نظر گرفت.
جهت تثبیت عملکرد نسل جدید باتری روی هوا ، باید چندین بار باتریها را تحت عمل پر شدن و تخلیه شدن قرار داد تا ماندگاری و بازدهی آنها تثبیت شود.
شاید خواندن مطلب زیر را دوست داشته باشید:









3 دیدگاه
[…] کامل باتریهای جیوهای شود. در ساختار و عملکرد این باتری ها، میزان آب در الکترولیت ثابت است؛ با افزایش فلوی هوا، […]
خیلی دنبال این موضوع بودم
[…] کامل باتریهای جیوهای شود. در ساختار و عملکرد این باتری ها، میزان آب در الکترولیت ثابت است؛ با افزایش فلوی هوا، […]