سرفصل های این مقاله
چکیده
لیتیوم هوا یک سیستم ذخیره انرژی جذاب است. استفاده موثر از هوا به عنوان الکترود باتری رویای دیرینه جامعه باتری بوده است.
هوا در اصل یک ماده ارزان است که با ظرفیت ویژه بسیار بالا تعریف شده است.
در مورد خاص از سیستم لیتیوم هوا، سطوح انرژی آن نزدیک به سطوح انرژی بنزین در نظر گرفته شده است. بنابراین تعجب آور نیست که در طول دهه گذشته، توجه زیادی از سوی آزمایشگاههای مختلف دانشگاهی و صنعتی در سراسر جهان به باتری لیتیوم هوا معطوف شده است.
با این حال، طولی نکشید که این تحقیقات زیاد مجموعهای از مسائل را نشان داد که از توسعه سریع سیستم الکتروشیمیایی لیتیوم هوا جلوگیری میکنند. اگرچه اخیراً پیشرفتهای زیادی حاصل شده است، اما این پرسش که آیا این باتری تأثیر اقتصادی و اجتماعی موثری خواهد داشت یا خیر بیپاسخ باقی مانده است.
در این مقاله بازبینی، ارزیابی انتقادی از پیشرفتهای انجام شده تا کنون، همراه با تلاش برای پیشنهاد روندهای تحقیق و توسعه آینده انجام شده است. همچنین پیش بینی اینکه آیا لیتیوم هوا میتواند در فناوری باتری سالهای آینده نقشی داشته باشد یا خیر در نظر گرفته شده است.
علت تجاری نشدن فناوری یون لیتیم
صنعت خودرو در حال حاضر به دلیل افزایش هزینههای مربوط به مالکیت خودرو و افزایش آگاهی زیست محیطی در بین مردم در جهان توسعه یافته با بحران روبرو است. برای مقابله با افزایش هزینههای نفت و گاز، مفاهیم جدید حمل و نقل مشترک مانند به اشتراک گذاری خودرو و همسفری در حال توسعه است، به افرادی است که در مناطق پرجمعیت شهری زندگی می کنند، ارائه میکند.
در همان زمان، نفوذ منابع انرژی تجدیدپذیر امکان ایجاد یک سیستم حمل و نقل عاری از CO2 را فراهم کرده است به طوری که وسایل نقلیه الکتریکی از انرژی های باد، آب و خورشیدی تغذیه میکنند.
تلاشهای مالی گستردهای در سطح دولتی و صنعتی برای تأمین هزینه تحقیقات در زمینههای جدید ذخیره انرژی در حال انجام است. وزارت انرژی ایالات متحده ۲۰ میلیون دلار به تحقیقات ذخیره انرژی در سال ۲۰۱۲ و ۱۵ میلیون دلار در سال ۲۰۱۳ اختصاص داده است، در حالی که دولت آلمان متعهد شده بود که بین سالهای ۲۰۱۱ تا ۲۰۱۸ مبلغ ۲۰۰ میلیون پوند در این زمینه اخصاص دهد؛ طرحهای مشابهی نیز در ژاپن توسط سازمان توسعه انرژی های نو و فناوری صنعتی (NEDO) ترویج میشود.
هدف برنامه “افق ۲۰۲۰” که توسط اتحادیه اروپا حمایت میشود، تأمین هزینه تحقیقات در زمینه فناوریهای ذخیره انرژی است؛ زمینهای که اتحادیه اروپا از ایالات متحده و شرق آسیا عقب مانده است.
فناوری یون لیتیوم در ۲۰ سال گذشته خود را به عنوان نوعی شیمی ذخیره انرژی قابل اعتماد معرفی کرده است که ابتدا در دوربین های فیلمبرداری، سپس تلفنهای همراه، لپ تاپها و اخیراً خودروهای برقی مورد استفاده قرار گرفته است. با این حال، با افزایش اندازه باتری، این باور بیشتر تقویت میشود که هزینه هر کیلووات ساعت و چگالی انرژی آن برای کاربردهای عملی خودرو مناسب نیست.
مدل S تسلا دارای ۴۰۰ کیلومتر رانندگی است، این کار را با یک باتری ۸۵ کیلووات ساعت بسیار بزرگ انجام میدهد که به تنهایی تا دو برابر قیمت یک خودروی معمولی اقتصادی گران است. با هزینه فعلی بیش از ۴۰۰ دلار در کیلووات برساعت، خودروهای برقی تا کنون تنها وارد یک بازار درجه یک و گران قیمت شدهاند که در آن کاربران مایل به پرداخت حق بیمه هستند.
تغییر اندازه باتری و هزینه کل ماشین برقی منجر به محدوده رانندگی (معمولاً ۱۰۰-۱۵۰ کیلومتر) میشود که به طور خودکار استفاده از سفرهای طولانی را محدود میکند و احساس “اضطراب راننده” را ایجاد میکند. به همین دلایل، نیاز به توسعه فناوریهای ذخیره انرژی که حداقل ۵۰۰ کیلومتر رانندگی را فراهم سازد و به طور همزمان حجم باتری مشابه را با قیمتی مقرون به صرفه حفظ کند، برای دولتها و خودروسازان مورد توجه است.
تاریخچه مختصری از باتری های لیتیوم هوا
در طول سالها، جامعه علمی توجه خود را بر روی یون لیتیوم پیشرفته و پیلهای سوختی متمرکز کرده است و تنها پیشرفتهای افزایشی در حال انجام است. پیش بینی می شود که فن آوری یون لیتیوم به طور خاص به دلیل ویژگیهای ذاتی خود در محدوده مشخصه انرژی ۲۵۰ وات ساعت بر کیلوگرم به حد مجانب برسد.
این به مقدار بسیار کم ۱۷۵۰ وات بر کیلوگرم از مخزن سوخت به چرخ بسیار کاهش مییابد که در حال حاضر با استفاده از بنزین در ایالات متحده به دست میآید. بنابراین، ضروری است که در جای دیگری به دنبال راه حل باشید. چند دهه پیش، باتریهای فلز هوا غیرقابل شارژ مرکز توجه قرار داشتند و اولین بررسی آن توسط بلورتون و سملز به سال ۱۹۷۹ برمیگردد.
در آن زمان، نویسندگان کاربردهای عملی وسایل نقلیه برای شیمی پیل لیتیم هوا را در نظر نگرفته بودند، در حالی که باتریهای روی هوا امیدوار کنندهتر بودند. با این حال، آن ها چگالی توان بالایی را که میتوان با چنین سیستمی به دست آورد، به دلیل ولتاژ مدار باز ۳ ولت و همچنین چگالی انرژی گرانشی نظری بسیار بالا که با Li2O به عنوان محصول تخلیه قابل دستیابی است، تشخیص دادند. (در آن زمان، مقدار خوشبینانه ۱۱۱۴۸ وات ساعت بر کیلوگرم ارائه شد)
علاقه به این موضوع در اواسط دهه۱۹۹۰، زمانی که ابراهام و همکارانش قابلیت شارژ مجدد برای سیستم Li/O2 گزارش کردند که در آن آند فلز لیتیوم، الکترولیت ژل پلی وینیلیدن دیفلوراید (PVdF) و زیرلایه کربنی برای کاتد O2 استفاده شد. دو واکنشی که احتمال می رود رخ دهند عبارتند از:
تجزیه و تحلیل کیفی منجر به شناسایی Li2O2 به عنوان محصول اصلی موجود در الکترودهای تخلیه شد. ظرفیتهای قابل توجهی در حدود ۱۶۰۰ میلی آمپر ساعت بر گرم کربن به دست آمد و اولین مشاهدات بر اهمیت مساحت الکترود هوا انجام شد.
علاقه به این موضوع با استفاده از الکترولیتهای مایع آلی به طور پیوسته افزایش یافت، که در میان آنها الکترولیت های مبتنی بر اتر به عنوان راه حلی برای حلالیت و انتشار محدود O2 توسط رید پیشنهاد شد. در حقیقت، این دو پارامتر گلوگاه الکترود O2 در اکثر الکترولیتها بود.
در سال ۲۰۰۶، بروس و همکارانش برگشت پذیری تشکیل Li2O2 را با استفاده از الکترولیت آلی مایع همراه با MnO2 به عنوان کاتالیزور نشان دادند. از آن زمان به بعد، فناوری لیتیم/هوا به سرعت در بین فناوریهای ذخیره انرژی الکتروشیمیایی که به عنوان راه حلی برای معمای چگالی انرژی پایین ارائه میشود، جایگاه برجستهای کسب کرد.
بسیاری از محققان در حال حاضر بر توسعه کاتالیزورهای پیشرفته و زیرلایههای کاتدی برای بهبود کارایی و عمر چرخه با استفاده از الکترولیتهای آلی تمرکز کرده اند. مواد استفاده شده به عنوان تکیهگاههای کاتدی شامل کربن متخلخل، گرافن، نانولولههای کربنی (CNT) یا نانو فیبرهای کربنی (CNF) با کاتالیزورهایی مانند اکسیدهای فلز (MnO2) ، Co3O4، فلزات نجیب و دیگران است.
در سال ۲۰۰۹ ، IBM پروژه “باتری ۵۰۰” را راه اندازی کرد که هدف بلند پروازانه آن توسعه باتری لیتیوم هوا بود که میتواند برد ۵۰۰ مایل را تضمین کند و تصور میشد که به زودی این فناوری به برنامههای کاربردی منجر شود. با این حال، هیجان اولیه به زودی فروکش کرد زیرا دانشمندان دریافتند که موضوع پیچیدهتر از آن چیزی است که در ابتدا پیش بینی میشد.
۲٫ دیدگاه دانشگاهی
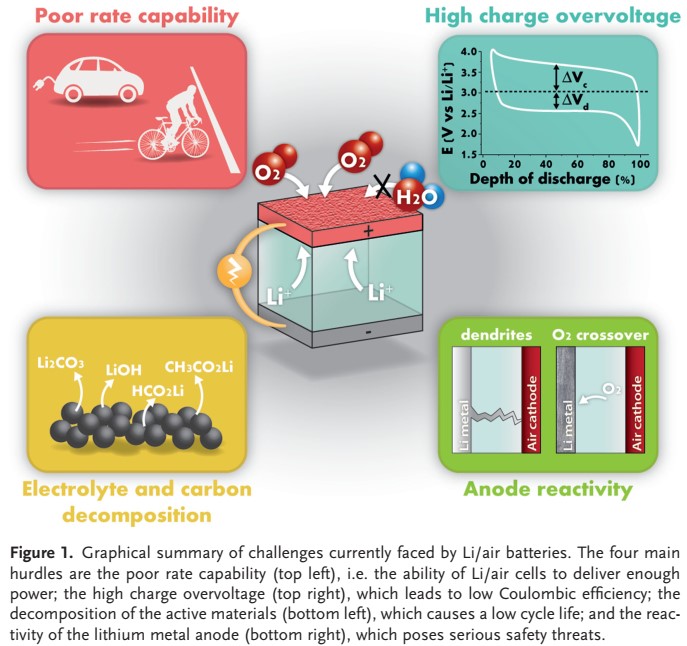
با وجود پیشرفتهای صورت گرفته در ۴۰ سال گذشته و شتاب زیاد در تلاشهای تحقیق و توسعه در دهه گذشته، باتری لیتیوم هوا هنوز در مراحل اولیه خود هستند. چندین ادعای خوش بینانه در حال حاضر کوچک شده است، در حالی که نقشه راه فناوری به دلیل برخی چالشهای حل نشده هنوز به پنجره ۲۰ ساله گسترش یافته است، که در شکل ۱ خلاصه شده است.
یکی از جنبههایی که نباید نادیده گرفت، نرخ قابلیت است. تا کنون، تنها چگالی جریان محدودی نشان داده شده است، به طور کلی یک یا دو مرتبه کمتر از آنچه در باتری لیتیوم تجاری نشان داده شده است.
اگر نمیتوان چگالی جریان بیشتری را بدست آورد، باید راه حلهای جایگزینی برای برآوردن میزان بالای O2 مورد نیاز برای کاربردهای حمل و نقل پیدا کرد. علاوه بر این، باید بیان کرد که اصطلاح “باتری لیتیوم هوا” اغلب با خوش بینی برای توصیف دستگاههایی که در واقع پیلهای Li/O2 هستند، به کار می رود، زیرا اکسیژن (و نه هوای خشک) در اکثرمطالعات باتری هوا لیتیوم به سیستم عرضه شده است.
ترکیبات اصلی هوای محیط عبارتند از: N2 (78٪) و O2 (21٪) و سایر گازها بقیه هوا را تشکیل میدهند. CO2 و رطوبت موجود در هوای محیط میتواند به طور قابل توجهی بر عملکرد الکتروشیمیایی یک پیل لیتیوم هوا تأثیر منفی بگذارد و حتی در مقادیر کم بر چرخه پذیری آن تأثیر منفی بگذارد. به عنوان مثال، فلز لیتیوم می تواند با وجود H2O در هوا واکنش داده و LiOH و H2 تولید کند.
آورباخ و همکارانش گزارش کردند که CO2 همچنین با یونهای Li+ واکنش میدهد و Li2CO3 را روی سطح الکترود تشکیل میدهد، در حالی که تاکاچی و همکاران نشان داند که Li2CO3 میتواند از واکنش بین CO2 و Li2O2 تشکیل شود.
اگر اکسیژن با هزینه کم انرژی از هوا گرفته شود، چگالی انرژی بالاتری میتوان از آن گرفت، انگیزه قابل توجهی برای توسعه راههایی برای حذف اجزای ناخواسته ایجاد میکند، به همین دلیل است که غشاهای انتخابی O2 شدیدا در حال توسعه هستند.
۲٫۱ الکترولیتها
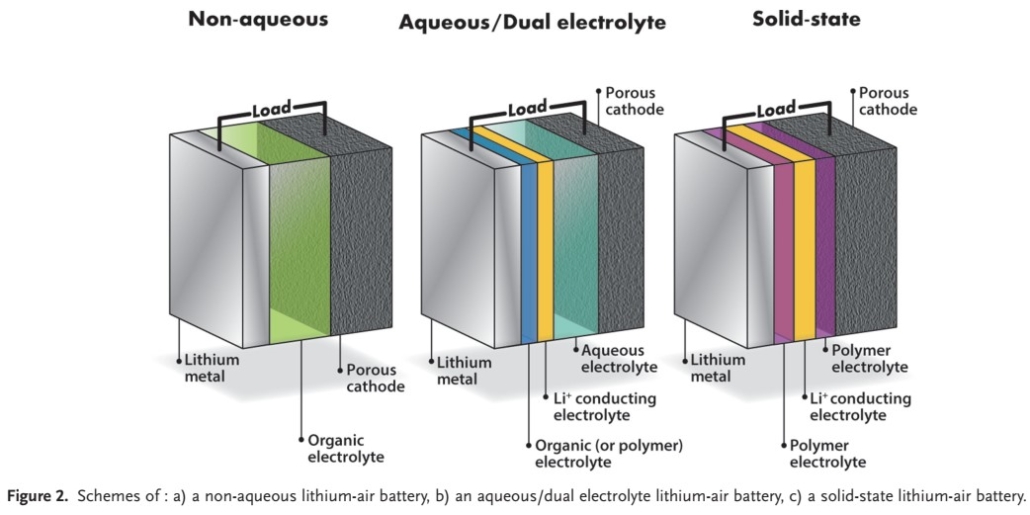
تا کنون تمرکز محققان دانشگاهی بیشتر بر روی پیلهای لیتیوم هوا آپروتیک بوده است، جایی که محصول اصلی تخلیه Li2O2 است. با این حال، خانواده باتری Li/O2 همچنین شامل سلولهای “حالت جامد”، “آبی” (گاهی اوقات هیبرید نامیده می شود) و “دو الکترولیت” میشود که ویژگیهای اصلی آنها در شکل ۲ نشان داده شده است.
۲٫۱٫۱ الکترولیتهای حالت جامد
باتری کاملا جامد لیتیوم هوا ابتدا توسط کومار و همکارانش توسعه داده شد. الکترولیت مورد استفاده در این مورد بر اساس لیتیوم آلومینیوم ژرمانیوم فسفات (LAGP) مخلوط با پلی اتیلن اکسید (PEO) بود. الکترود کربن از کربن سیاه دوپ شده با نیتروژن و کربن فعال شده با کالگون ساخته شده بود.
این باتری پتانسیل تخلیه بالا و پتانسیل شارژ کم به ترتیب ۲٫۸ ولت و ۳٫۶ ولت را در دمای عملیاتی ۷۵ درجه سانتی گراد نشان میدهد. ژو و همکاران همچنین باتری لیتیوم هوا را با استفاده از پیکربندی Li/CE (الکترولیت سرامیکی)/LAGP@CNT (نانولوله کربنی) مورد بررسی قرار دادند.
یک باتری لیتیوم هوا با حالت جامد با استفاده از یک الکترولیت لیتیوم فسفر اکسی نیترید (LiPON) با یک آند لیتیوم (LLTO) Li4Ti5O12 و زیرلایه کاتدی اکسید وانادیوم (V2O5) نیز اخیراً توسط لو و همگاران آزمایش شده است که Li2O2 را به عنوان محصول اصلی تخلیه تایید کردند.
۲٫۱٫۲ الکترولیتهای آبی
باتری لیتیوم هوا در مقایسه با سیستمهای غیر آبی دارای مزایای زیادی هستند، یعنی پتانسیل تخلیه بالا، کارآیی بالا در رفت و برگشت، عدم وجود محصولات تخلیه جامد که باعث انسداد منافذ الکترود میشوند و عدم خوردگی فلز لیتیوم توسط رطوبت هوا. علاوه بر این، از استفاده از نمکهای لیتیوم گران قیمت در کاتولیت جلوگیری میشود زیرا تجزیه، حلالیت و رسانایی بیشتر از نمونه غیر آبی است.
مزیت دیگر استفاده از کاتالیزورهای غیر نجیب است که اجازه انتقال چهار الکترون در کاتد را میدهد و منجر به موارد زیر میشود:
بستگی به pH، می توان به پتانسیل ۳٫۴-۴٫۳ ولت در مقابل فلز لیتیم رسید. کاتد در یک کاتولیت آبی عمل میکند که با لایههای الکترولیت معدنی ویا آلی اضافی از آند لیتیم جدا شده است.
این دسته برای اولین بار در دهه ۱۹۷۰ در لاکهید مورد بررسی قرار گرفت. در این سیستم، یک آند فلزی لیتیوم در محلول غلیظ LiOH غوطه ور میشود و در حین تخلیه، منجر به تشکیل LiOH می شود که تا حدی در الکترولیت محلول است:
هنگامی که غلظتLiOH از ۵٫۲ مولار تجاوز کند با آب کریستالی رسوب می کند، بنابراین پیلهای لیتیوم هوا آبی با محدودیت ذاتی ۴۷۷ وات ساعت بر کیلوگرم در انرژی تئوری ویژه روبرو هستند، اگرچه ممکن است بتوانند با همتای غیر آبی خود در اصطلاح حجمی رقابت کنند.
در صورت استفاده از محلول اسیدی، ولتاژ تخلیه ۳٫۴ ولت و در نهایت انرژی ویژه ۷۰۰ وات ساعت بر کیلوگرم فراهم میشود و حلالیت LiOH می تواند افزایش یابد. متناوباً، با ذخیره و یا رسوب هیدروکسید لیتیوم در مخزن با پیشرفت تخلیه پیل، می توان انرژی ویژه را افزایش داد.
البته یکی دیگر از عواملی که باید در طراحی چنین پیلهایی مورد توجه قرار گیرد، واکنش لیتیوم در محیط آبی است. در اولین تلاشهایی که برای پسیواسیون الکترود لیتیوم انجام شد، سیستم دچار خوردگی و همچنین تولید H2 شد و بلافاصله پس از آن متوقف شد.
توسعه سیستم آبی پس از آنکه ویسکو و همکارانش الکترولیت جامد رسانای لیتیوم را در سال ۲۰۰۴ توسعه دادند، امکان پذیر شد. این الکترولیت شامل یک لایه رسانای یون لیتیوم-یا لیتیوم نیترید (Li3N) یاLiPON -بین الکترولیتهای رسانای لیتیوم و آند فلز لیتیوم است و از واکنش فلز لیتیوم با آب برای تشکیل LiOH و گاز هیدروژن جلوگیری میکند.
با این حال، هدایت این الکترولیت جامد محافظ در طول کار به دلیل افزایش pH الکترولیت از انحلال LiOH به میزان قابل توجهی کاهش مییابد. ایمانیشی و همکارانش با کاهش موثر pH به این موضوع پرداختند و در نتیجه الکترولیت محافظ سرامیک-شیشه (LATP) مورد استفاده آنها را تثبیت کردند. افزودن LiCl در محلول آبی اشباع شده با ۵٫۱۲ مولار LiOH مقدار pH را به ۸٫۱۴ کاهش داده و پایداری LATP در محلول آبی را به دلیل غلظت بیشتر یونهای Li+ بهبود داده است.
اگرچه کاهش غلظت قلیایی در محلول آبی واکنش پذیری را با LATP به حداقل میرساند اما هنوز الکترولیتهای جامد تخریب شده در حضور آندهای فلزی لیتیوم را برطرف نمیکند. علاوه بر این، از دست دادن تماس بین دو ماده ناشی از تغییرات حجم میتواند منجر به عملکرد ضعیف و عمر کوتاه شود.
این دو کاستی با استفاده از الکترولیتهای پلیمری پایه پلی اتیلن اکسید (PEO) به عنوان اولین الکترولیت در تماس با فلز لیتیم برطرف شد. این پلیمر هم انعطاف پذیری را ایجاد میکند که از بین رفتن تماس را کاهش میدهد و هم پایداری شیمیایی مورد نیاز در برابر فلز لیتیوم را فراهم میکند.
برای افزایش بیشتر عملکرد سلولهای آبی لیتیوم هوا، ویسکو و همکارانش و وانگ و ژو یک چیدمان الکترولیت دوگانه را مورد بررسی قرار دادند، در حالی که دومی از الکترولیت اتیلن کربنات دی متیل کربنات برای جداسازی فلز لیتیم و محفظه آبی استفاده کردند.
با این حال، یک محدودیت برای این رویکرد این است که هرچه لایههای بیشتری استفاده شود، محدودیت های حمل و نقل توده Li+ بیشتر آشکار میشود که مانع از استفاده از چگالی جریان بیشتر از مواردی است که برای چیدمان غیر آبی استفاده میشود. همچنین، اگرچه این سیستم مزایایی دارد، اما فرآیند ساخت آن پیچیده و چالش برانگیز است.
۲٫۱٫۳ الکترولیتهای غیر آبی
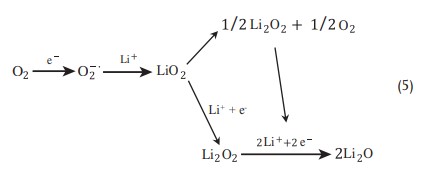
در الکترولیتهای آپروتیک، مکانیسم فرایند احیای اکسیژن از طریق مراحل متوالی که شامل تشکیل رادیکال اکسیژنO2-. میشود، منجر به پراکسید لیتیوم میشود.
این گونه الکتروشیمیایی واکنش میدهد و در ابتدا LiO2 میدهد، پس از آن یک واکنش شیمیایی منجر به لیتیم پراکسید میشود:
آنیون رادیکال اکسیژن بسیار واکنش پذیر است و اگرچه دارای طول عمرکوتاه است اما به اندازه کافی فعال است تا اکثر الکترولیتهای رایج را تجزیه کند، مانند محلولهای کربنات آلی که معمولاً در باتریهای لیتیوم یون معمولی استفاده میشوند. این استرها که دارای گروه کربونیل الکتروفیل بسیار قوی هستند در واقع به راحتی توسط گونههای نوکلئوفیل پراکسید و سوپراکسید مورد حمله قرار میگیرند که منجر به باز شدن هتروسیکل و متعاقب آن تشکیل کربناتهای خطی میشود.
در واقع، تلاشهای اولیه برای استفاده از باتریهای لیتیوم هوا با استفاده از الکترولیتهای کربناته منجر به شکست پیل پس از چند چرخه شد زیرا فرآیند کلی تحت تجزیه الکترولیتها قرار داشت. به همین دلیل، الکترولیتهای کربنات آلی معمولی اکنون کاملاً رها شدهاند.
در نتیجه انتخاب یک الکترولیت مناسب و پایدار یک چالش عمده در فناوری باتری لیتیوم هوا بوده است. بسیاری از سیستمهای حلال که نتایج آنها در جدول ۱ خلاصه شده است برای رسیدن به این هدف مورد بررسی قرار گرفتهاند.
از جمله آنها لیتیوم تریفلات (LiCF3SO3) محلول در تترا اتیلن گلیکول دی متیل اتر (TEGDME) است که به دلیل ویژگیهای الکتروفیلیک ضعیف گلایمها مقاومت در برابر خوردگی نوکلئوفیلی را تضمین میکند، در حالی که نمک پرسولفونات به پایداری شیمیایی کمک میکند.
۲٫۱٫۴ الکترولیتهای برپایه کربنات
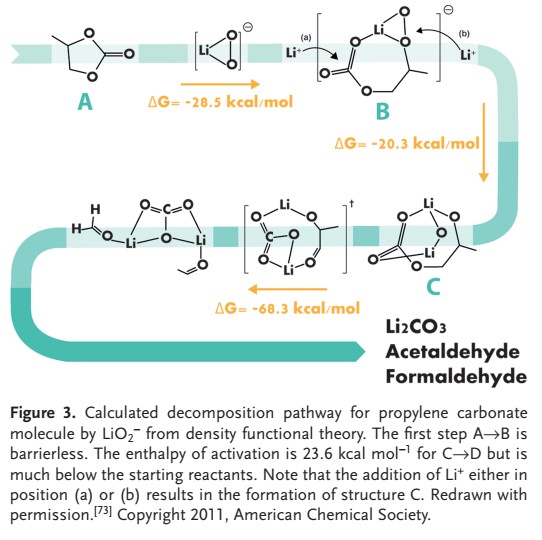
پلاریزاسیون بالای ناشی از واکنش تصاعد اکسیژن (OER) و عملکرد متوسط چرخهای باتریهای لیتیوم هوا، دستیابی به کارآییهای رفت و برگشت را با باتریهای لیتیوم یونی دشوار کرده است. میزونو و همکاران گزارش کردند که محصول تخلیه لیتیوم هوا با استفاده از الکترولیتهای آلی عمدتا Li2CO3 و آلکیل کربنات های لیتیوم (RO (C = O) OLi) به جای Li2O2 بوده و تجزیه الکترولیتهای مبتنی بر کربنات پروپیلن (PC) را مسئول میداند.
برای شکل گیری این محصولات در پی این مطالعه، چندین محقق توانستند مکانیزم تجزیه الکترولیتهای برپایه کربنات را تعیین کنند. به عنوان مثال، ژانگ و همکاران نظریه تابعی چگالی (DFT) را انجام داند و تعیین کرند که باز شدن حلقه PC در حضور گونههای حل شده مانند O2– ، LiO2 ، LiO2–و Li2O2 هیچ مانع انرژی ندارد (شکل ۳)، تشکیل Li2CO3 و لیتیوم آلکیل کربنات را تسهیل میکند.
وجود این ترکیبات توسط طیفسنجی تبدیل فوریه فروسرخ (FTIR) و طیف سنجی فوتوالکترون اشعه ایکس (XPS) تایید شد. همراه با Li2CO3 ، C3H6(OCO2Li)2،CH3CO2Li و HCO2Li ، بروس و همکارانش همچنین CO2 و H2O را به عنوان محصولات تخلیه پیل لیتیوم هوا مبتنی بر PC با استفاده از FTIR ، رزونانس مغناطیسی هستهای (NMR) و طیف سنجی رامان افزایش یافته سطح (SERS) ، همراه با طیف سنجی جرمی الکتروشیمیایی دیفرانسیلی (DEMS)، ژانگ و همکارانش از پراش اشعه ایکس (XRD) و DEMS برای تأیید تشکیل Li2CO3 در طول فرآیند تخلیه و تصاعد CO2 در طول شارژ استفاده کردند.
۲٫۱٫۵ الکترولیتهای برپایه اتر
پس از تأیید ناپایداری الکترولیتهای کربناته، تلاش تحقیقاتی برای پذیرش الکترولیتهای جدید برای باتریهای لیتیوم هوا غیر آبی اختصاص یافت. در میان حلالهای آلی مورد بررسی، الکترولیتهای برپایه اتر بهترین گزینه بودند.
در سال ۲۰۰۶، رید اولین کسی بود که از یک الکترولیت برپایه اتر در یک باتری لیتیوم هوا غیر آبی استفاده کرد در حالی که برایانتسف و همکارانش از تئوری تابعی چگالی (DFT) برای محاسبه پایداری طیف وسیعی از حلالهای آلی در برابر خوردگی رادیکال O2-. استفاده کردند.
محاسبات نشان میدهد که الکترولیتهای برپایه اتر مناسبتر از آنهایی هستند که بر پایه کربنات هستند. با این وجود، تعدادی از دانشمندان نتایج متفاوتی را با این کلاس از الکترولیتها گزارش کردند به طوری که برخی از آنها بهبود عملکرد الکتروشیمیایی و چرخهای (تا ۱۰۰ چرخه) را نشان دادند و برخی دیگر پدیدههای تجزیه را گزارش کردند.
به عنوان مثال، مک کلسکی و همکاران تجزیه الکترولیت دی متیوکسی اتان (DME) را در یک پیل لیتیوم هوا در حین چرخه مشاهده کردند. در مطالعه آنها تصاعد گاز CO2 توسط DEMS در ناحیه ۴ ولت تشخیص داده شد.
فرونبرگر و همکاران تجزیه DME را در طول فرآیند تخلیه با استفاده از تجزیه و تحلیل XRD و FTIR مطالعه کردند و مکانیسم تجزیه ای را پیشنهاد کردند که در آن تشکیل پیشرونده Li2CO3 صورت میگیرد.
شو و همکاران تجزیه را با استفاده از XRD ، DEMS ، NMR و XPS نشان دادند.
علیرغم تجزیه احتمالی الکترولیتهای برپایه اتر، هنوز در سیستمهای غیر آبی لیتیوم هوا بیشترین مطالعه را داشتند.
۲٫۱٫۶ سایر الکترولیتهای غیر آبی
چندین الکترولیت غیر آبی دیگر برای باتریهای لیتیوم هوا گزارش شده است، مانند استونیتریل (ACN) ، دی متیل فرمامید (DMF)، تری (اتیلن گلیکول) تری متیل سیلان (۱NM3)، N-methyl-2-pyrrolidone (NMP)، دی متیل سولفوکسید (DMSO)N ، N-dimethylacetamide (DMA)، سولفولان و مایعات یونی. در میان این الکترولیتهای آلی، DMSO توسط پنگ و همکارانش به طور کامل مورد بررسی قرار گرفت و نشان داد که ۰٫۱ مول محلول LiClO4 در DMSO می تواند عملکرد الکتروشیمیایی بسیار پایداری با استفاده از طلا به عنوان زیرلایه کاتد ارائه دهد.
محصول تخلیه اصلی با الکترولیت برپایه DMSO، Li2O2 بدون تجزیه الکترولیت قابل توجه پس از ۱۰۰ چرخه بود. با این حال، تشکیل محصولات تجزیه (مانند HCO2Li) هنگام استفاده از الکترود سوپر P مشاهده شد و DMSO علت احتمالی در نظر گرفته شد. اخیراً، واکنش DMSO در حضور Li2O2 با اندازه گیری IR و XPS درجا تأیید شده است.
۲٫۲ آند
با توجه به مقادیر بالای الکتروشیمیایی آند، یعنی ولتاژ آبکاری -۳٫۰۵ ولت در مقابل الکترود هیدروژن استاندارد (SHE) ، ظرفیت ۳٫۸۶ آمپرساعت بر گرم (۲٫۰۶ آمپرساعت بر سانتی متر مکعب)، از نظر تئوری فلز لیتیوم یک الکترود ایده آل است. با این حال، استفاده عملی از آن به دلیل تمایل به رسوب نامنظم و در نتیجه تشکیل دندریتهایی که ممکن است در سراسر پیل رشد کنند، ممنوع شده و در نهایت یک خطر جدی برای ایمنی ایجاد میکند.
نشان داده شده است که هم جدایش سطح لیتیوم و هم رشد مداوم یک لایه الکترولیت جامد ناپایدار (SEI) منجر به کاهش ظرفیت در طول چرخه میشود. بنابراین تا زمانی که به درستی محافظت نشده و یا با یک الکترولیت مناسب ترکیب نشود ، فلز لیتیوم نمیتواند به عنوان الکترود برای تولید باتری پیشنهاد شود.
این مورد در مورد باتریهای لیتیوم هوا نیز صادق است. علاوه بر این، تخریب تدریجی سطح فلز لیتیم نیز می تواند به دلیل همپوشانی O2 رخ دهد، پدیدهای که باعث تجزیه الکترولیتها در حین شارژ روی آند میشود و منجر به تشکیل LiOH و Li 2CO3 میشود. به طور شگفت انگیزی این موضوع به طور کلی نادیده گرفته میشود زیرا بیشتر کارها در این زمینه هنوز بر اساس سیستمهایی است که از لیتیوم به عنوان آند استفاده میشود و در حالی که مقالات زیادی چالشهای مربوط به الکترولیتها و تکیه گاههای کاتدی را بررسی میکنند، مطالعات نسبتاً کمی در زمینه آند انجام شده است.
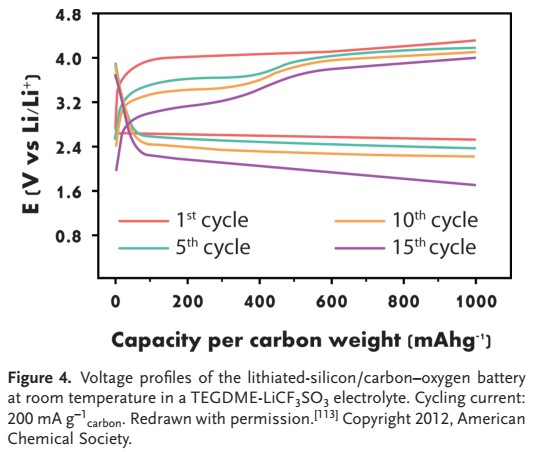
روی آند اخیراً تلاشهایی برای حل این مسئله توسط حسون و همکارانش گزارش شده است که پیشنهاد جایگزینی فلز لیتیوم با کامپوزیت لیتیوم کربن سیلیکون را دادهاند. LiSi-C، یکی از موارد نادر چیدمان “باتری یون-لیتیوم هوا” را نشان میدهد. باتری به طور برگشت پذیر با ظرفیت ۱۰۰۰ میلی آمپر ساعت بر گرم کربن به مدت ۱۵ چرخه کار میکند تا این که احتمالاً به دلیل همپوشانی O2 و در نتیجه خرابی الکترود کامپوزیت Si-C از بین برود (شکل ۴ را ببینید)
در واقع، همپوشانی اکسیژن یک عیب جدی در سمت آند است که تا کنون دست کم گرفته شده است. یک راه حل واضح حفاظت از آند با غشایی است که در برابر اکسیژن نفوذ نکند. با این حال، این رویکرد ممکن است منجر به مشکلات اضافی ناخواسته، مانند افزایش مقاومت کلی پیل و اتلاف الکتریسیته مرتبط شود.
به عنوان یک رویکرد جایگزین، الکترولیتهای ژل -پلیمر برای سرکوب تشکیل دندریتهای لیتیم استفاده شده است که با این وجود هنوز هم ممکن است رخ دهد و منجر به نفوذ فیلم پلیمر، به رفتار چرخهای ضعیف و در نهایت به از بین رفتن پیل شود.
آلشین و همکاران سعی کردند این مشکل را با پوشاندن آند فلز لیتیوم با یک لایه سرامیکی محافظ متشکل از شیشه و سرامیک لیتیوم – آلومینیوم – ژرمانیوم – فسفر (LAGP) حل کنند. این لایه به منظور تثبیت عملکرد لیتیوم هوا با جلوگیری از تخریب آند و الکترولیت در نظر گرفته شد. با این حال، عملکرد سلول فقط برای ده چرخه مورد آزمایش قرار گرفت و تأیید تأثیر طولانی مدت یک لایه محافظ سرامیکی را دشوار کرد. اخیراً، گروههای دیگر راههای جدیدی برای تهیه ورق های LAGP از جمله سنتز سل- ژل و ریخته گری نوار توسعه دادهاند.
۲٫۳ زیرلایه کاتدی
از لحاظ تئوری، انرژی ویژه باتری لیتیوم هوا با مقدار لیتیم پراکسید (Li2O2) که از ترکیب اکسیژن احیا شده و یونهای لیتیوم در هنگام تخلیه تشکیل میشود، تعیین میشود. در عمل، ظرفیت تخلیه به مراتب کمتر از مقدار مورد انتظار در تمام تحقیقات انجام شده تا به امروز است و نرخ ظرفیت آن از سایر سیستمهای تبدیل انرژی پایینتر است.
چگالی انرژی بالای باتریهای لیتیوم هوا تا حدی ناشی از جرم کم الکترود مثبت است که معمولاً از یک زیرلایه رسانا، یک کاتالیزور و یک اتصال دهنده تشکیل شده است، در مقایسه با باتریهای لیتیوم یونی که در آن از اکسیدهای فلزات انتقالی سنگین به عنوان مواد فعال استفاده میشوند. با این نوع زیرلایه و استفاده از الکترولیت پایدار، پیل میتواند در مرحله تخلیه، یعنی واکنش احیای اکسیژن (ORR) ، به خوبی عمل کند و منجر به تشکیل Li2O2 شود.
در عوض یک ولتاژ اضافی معمولاً در مرحله شارژ مخالف یا واکنش اکسیداسیون اکسیژن (OER) تشخیص داده میشود که منجر به بازدهی ضعیف انرژی میشود. از این رو، از طریق جستجوی کاتالیزورهایی که می وانند ولتاژ OER را کاهش دهند، توجه به این موضوع معطوف شده است.
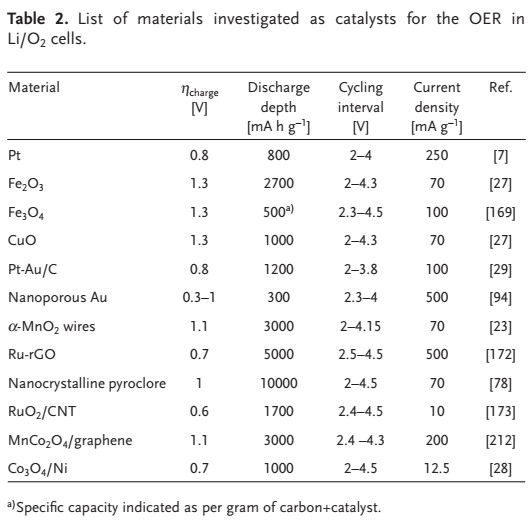
برای رسیدن به این هدف، مواد مختلف مورد آزمایش قرار گرفتهاند (جدول ۲ را ببینید). با این حال، هیچ یک از آنها انتخاب نهایی نیستند و یک کاتالیزور موثر واقعی OER باید مشخص شود. یکی دیگر از نگرانیهای جدی در کاتد خوردگی کربن که در طول فرآیند شارژ رخ میدهد، است که در نهایت با تصاعد CO2 منجر به خرابی پیل میشود.
نقصی که هنوز با کاتد مرتبط است و هنوز حل نشده است توان پایین پیل است که با چگالی جریان کم قابل دستیابی است به طور معمول در حدود ۰٫۱ میلی آمپر سانتی متر بر متر مربع، ارتباط تنگاتنگی دارد.
جایگزینهای چیدمان کربنی نانوساختار، مانند گرافن، لولهها، فومها و نانوالیاف میتواند راه حلی برای این امر باشند زیرا انتظار میرود سطح بزرگ و رسانایی الکترونیکی آنها با ارائه شار موثر یون لیتیم (+Li)، سینتیک فرایند الکتروشیمیایی را افزایش دهد و مقادیر مقاومت انتقال بار را کاهش میهد. از سوی دیگر، این رویکرد ممکن است به کاهش بیشتر چگالی انرژی حجمی باتری Li/O2 کمک کند که قبلاً با زیرلایههای کربنی استاندارد پایین در نظر گرفته شده بود.
واکنش در الکترود مثبت باتریهای لیتیوم هوا حول یک فعل و انفعال سه فازی بین زیرلایه الکترود (فاز جامد) ، یونهای لیتیوم در الکترولیت (فاز مایع) و اکسیژن مولکولی (فاز گاز) میچرخد. با این حال، وضعیت برای پیلهای غیر آبی لیتیوم هوا به دلیل ماهیت نامحلول محصولات تخلیه پیچیدهتر است.
مکانیسم تشکیل تجزیه Li2O2 هنوز به طور قطعی ثابت نشده است. رسوب جامد غیر رسانا Li2O2 میتواند بر روی ساختار زیرلایه متخلخل انباشته شده و باعث انسداد سطح موجود برای تشکیل بیشتر Li2O2 شود. مسیر انتقال گاز اکسیژن و یون های لیتیوم را نیز میتوان با رسوب Li2O2 مسدود کرد که منجر به افزایش مقاومت پیل میشود.
هنگامی که اندازه حفره بسیار کوچک باشد، مانند میکروحفره ها (کوچکتر از ۲ نانومتر)، ورودی منافذ به راحتی مسدود میشود و باعث میشود مکانهای فعال الکتروشیمیایی واقع شده در عمق بیشتری در زیرلایه کاتد غیرقابل دسترسی باشند. در نتیجه با وجود مساحت زیاد ، به ظرفیتهای ضعیف مشخصی میرسد.
برای پیچیده تر شدن کار، عملکرد باتریهای لیتیوم هوا فقط توسط سطح، تخلخل یا اندازه حفره الکترود هوا تعیین نمیشود، بلکه توسط تعامل پیچیدهتری از این اجزا تعیین میشود. به عنوان مثال، در حالی که نشان داده شده است که معماری نیمه متخلخل (با منافذ بین ۲ تا ۵۰ نانومتر) بهترین عملکرد را دارد، هنوز از گرفتگی ناشی از Li2O2 غیر رسانا رنج میبرد. برای اجتناب از این امر، نیمه متخلخل باید توسط کانالهای هدایت +Li پشتیبانی شوند، جایی که در حالت ایده آل، تجمع محصول تخلیه انجام نمیشود.
پس واضح است که دو لایه کاتدی با مساحت مشابه اما توزیع ساختار اندازه منافذ متفاوت رفتار مشابهی از خود نشان نمیدهند. با این حال، اگرچه انتظار نمیرود هیچ اثر تونل زنی الکترون در Li2O2 زمانی رخ دهد که ضخامت آن بیش از ۱۰ نانومتر باشد اما ساختارهای بزرگ تا ۱۰۰۰ نانومتر به صورت تجربی مشاهده شدهاند، احتمالاً از کاهش +Li و در نتیجه افزایش −O2 ناشی شده است. طول نفوذ این امر ملاحظات قبلی را زیر سال می برد و به عوامل بیشتری وابسته میشود، مانند میزان نقص در سطح الکترود هوا، خیس شدن الکترود و همچنین دسترسی O2 به منافذ، مورفولوژی و استوکیومتری محصولات تخلیه و در نهایت پروتکل چرخهای (به عنوان مثال، چگالی جریان، عمق تخلیه، محدوده ولتاژ).
بنابراین، تعیین پارامترهای بسیار مهم که بر عملکرد باتریهای لیتیوم هوا تأثیر میگذارند، همچنان مشکل است. در بخشهای بعدی، ما در مورد مواد مختلفی که در کاتد استفاده شده است بحث میکنیم.
۲٫۳٫۱ کربن متخلخل
ساختارها و آلوتروپهای مختلف کربن به دلیل هزینه کم، رسانایی زیاد، حجم منافذ زیاد، سطح وسیع و پردازش آسان مورد توجه هستند. بنابراین کربن برای حل مشکلات فوق الذکر بسیار مناسب است، به همین دلیل است که به عنوان زیرلایه و کاتالیزور الکترود مثبت به عنوان انتخاب اصلی تبدیل شده است.
علاوه بر این، اثر کاتالیزوری کربن، مشاهده شده بر روی ORR و قابل توصیف نقصهای آن است، نشان میدهد که ممکن است کاتالیزور اضافی برای کاهش اکسیژن ضروری نباشد. اشکال تجاری مختلف سیاه کربن (به عنوان مثال ،سوپرP، کتجن بلک و کربن ولکان به عنوان زیرلایههای الکترود مثبت در باتری های لیتیوم هوا استفاده شده است).
با توجه به موفقیت محدود کربنهای تجاری، بسیاری از محققان سعی کردهاند ساختارهای جدیدی را برای بهبود عملکرد توسعه دهند. یانگ و همکارانش گزارش کردند که فوم کربن بین سلولی (MCF-C) با حجم منافذ بزرگ و ساختارهای نیمهمتخلخل بزرگ ظرفیت تخلیه بالاتری نسبت به کربن سیاه تجاری نشان میدهد.
ژای و همکاران نشان دادند که دو نوع محصول تخلیه، یعنی Li2O2 و LiO2، بر روی منافذ کربن فعال ایجاد شده و تأکید کردند که دومی میتواند پتانسیل شارژ را کاهش دهد. گوئو و همکارانش توانایی کانالهای نیمه متخلخل مرتب شده را برای بهبود فرایند انتقال الکترون و تسهیل نفوذ +Li برجسته کردند.
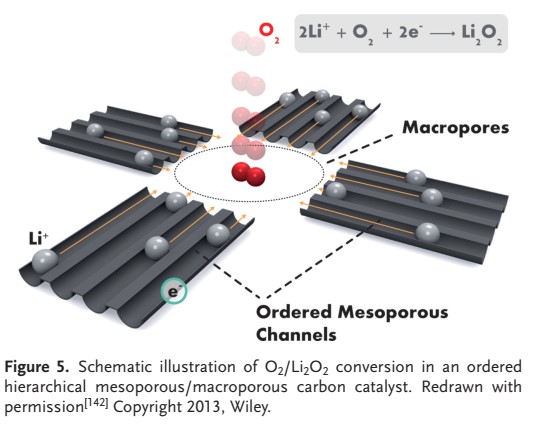
در ساختار خود، ماکروحفرهها، احاطه شده توسط كانالهاي نیمه متخلخل مرتب ميتوانند فضايي براي نفوذ O2 و تشكيل تجزيه Li2O2 فراهم كنند، همانطور كه در شكل ۵ نشان داده شده است. نانولولههای کربنی (CNT) و مشتقات آنها به دلیل خواص منحصر به فرد خود (برای مثال سطح زیاد، رسانایی، فعالیت کاتالیزوری و پایداری در اکسیداسیون) برای استفاده در باتری های لیتیوم هوا در نظر گرفته شدهاند.
میچل و همکارانش گزارش کردهاند که نانو فیبرهای کربنی (CNF) فعالیت کاتالیزوری ORR کارآمد و ظرفیت تخلیه بالا را نشان میدهند. فیبر مستقیماً بر روی یک زیرلایه متخلخل با استفاده از روش رسوب بخار شیمیایی (CVD)، بدون نیاز به چسب، رشد داده شد.
CNFها دارای ظرفیت تخلیه فوق العاده بالایی از ۷۲۰۰ میلی آمپر ساعت بر گرم و انرژی گرانشی تا ۲۵۰۰ وات ساعت بر کیلوگرم هستند. CNTهای تحت عملیات حتی نتایج بهتری نشان دادند. به عنوان مثال، لی و همکاران CNTهای تا حدی ترک خورده را بر روی زیرلایه اعمال کردند و ظرفیت آن را تقریباً دو برابر CNTهای بدون ترک (۱۵۱۳ میلی آمپر ساعت بر گرم در مقابل ۸۰۰ میلی آمپر در ساعت برگرم) نشان دادند.
می و همکاران دریافتند که استفاده از CNTهای حاوی نیتروژن در زیرلایه، ظرفیت الکترولیتهای برپایه کربنات (PC/EC) و برپایه اتر (DOL/DME) را فراتر از CNTهای غیرعملیاتی افزایش میدهد. به تازگی، یک الکترود کربن الیافی- سلسله مراتبی با سازماندهی متعارف صفحات جداگانه CNTها ایجاد شده است.
با بهبود انتقال جرم کارآمد در چارچوب باز، این الکترود میتواند ظرفیت بالای ۱۰۰۰ میلی آمپر ساعت بر گرم با عملکرد خوب تا ۷۰-۸۰ چرخه را ارائه دهد. لیو و همکاران با استفاده از CNT سلسله مراتبی متخلخل ساخته شده از طریق قالب کلوئیدی با استفاده از فیلتر خلاء و بازپخت پس از بازسازی، یک الکترود ایستاده آزاد تولید کردند.
اگرچه میزان بارگیری کربن ۷-۵۰ برابر بیشتر از آنچه قبلا برای سایر الکترودهای کربنی آزاد گزارش شده بود، است اما این الکترود همچنان دارای ظرفیت بالای ۴۶۸۳ میلی آمپر ساعت بر گرم و انرژی گرانشی ۱۲۸۳۰ وات بر ساعت بر کیلوگرم است. نکته دیگر، CNTها درآنالیز چشمی مورفولوژی Li2O2 به روشنی و قابل تشخیص مفید بودهاند.
شاو-هورن و همکارانش تشکیل و مورفولوژیکی تصاعد Li2O2 در طول تخلیه را مورد بررسی قرار دادند و رابطه بین مورفولوژی Li2O2 و عملکرد الکتروشیمیایی باتری های لیتیوم هوا را تایید کردند. یکی دیگر از گزینههای جذاب، گرافن است به دلیل هدایت الکتریکی عالی (بالاتر از CNT)، سطح ویژه بالا و استحکام مکانیکی قابل توجه، که ناشی از ساختار دو بعدی منحصر به فرد آن است، مورد توجه گسترده قرار گرفته است .
لی و همکاران نشان دادند که نانو ورقهای گرافن (GNS) میتوانند ظرفیت تخلیه بالاتر (mAh g-1 8706) نسبت به BP-200 (1909 mA h g–1) و XC-72 کربن ولکان (mA h g-11054) تحویل دهند. سان و همکاران بهبود عملکرد کاتالیزوری و تخلیه GNSها بر روی کربن ولکان XC-72 را تأیید کردند.
در حقیقت، تخلیه به دست آمده با ورقهای نانو برابر با ۲۳۳۲ میلی آمپر ساعت بر گرم در مقابل ۱۶۴۵ میلی آمپر ساعت بر گرم برای ولکان XC-72 بود. علاوه بر این، اختلاف پتانسیل بین فرآیندهای تخلیه و شارژ الکترود GNS ۱٫۲۲ ولت بود که به میزان قابل توجهی کمتر از نمونه مشابه ولکان آن (۱٫۶۹ V) بود. شیائو و همکاران یک ساختار متخلخل سلسله مراتبی سه بعدی با نانو ورقهای گرافن ۲ بعدی به عنوان الکترود کربنی متخلخل تهیه کردند.
ساختار سه بعدی که شامل کانالهای منفذی به هم پیوسته در مقیاس های طول میکرو و نانومتر است، ظرفیت فوق العاده بالایی ۱۵۰۰۰ میلی آمپر ساعت بر گرم (هرچند در بخش خوبی غیرقابل برگشت) با یک حالت پایدار در حدود ۲٫۷ ولت ارائه داد. علاوه بر این، محاسبات DFT نشان داد که نواقص و گروههای عملکردی روی گرافن میتوانند تشکیل نانو ذرات Li2O2 ایزوله شده را تسهیل کرده و بنابراین از مسدود شدن هوا در الکترود هوا جلوگیری کنند.
۲٫۳٫۲٫ تجزیه کربن
اگرچه کربن پتانسیل بالایی به عنوان ماده زیرلایه برای کاتدها نشان میدهد اما مناسب بودن آن به دلیل مسائل مربوط به پایداری شیمیایی مورد بحث است.
استفاده از الکترود ایزوتوپ کربن-۱۳ (۱۳ C)، مک کلسکی و اسپیدل نشان دادند که اکسیداسیون الکترود کربن به همراه الکترولیت به تشکیل Li2CO3 در اثر واکنش Li2O2 در سطح کربن، از نظر تئوری منجر به کاهش ۱۰ تا ۱۰۰ برابر در چگالی جریان مدار باز میشود.
اتاکام توتییل و همکاران نیز پایداری الکترود کربن و الکترولیت غیر آبی در اثر خوردگی Li2O2 مورد بحث قرار دادند. آنها دریافتند که کربن در هر دو فرآیند تخلیه و شارژ، به ویژه در مورد کربن آبگریز، زیر ۳٫۵ ولت نسبتاً پایدار است اما در حضور Li2O2 بالاتر از ۳٫۵ ولت ناپایدار است.
بنابراین، نمیتوان پایداری الکترود و الکترولیت را به طور جداگانه در نظر گرفت و در صورت استفاده از کربن در یک باتری لیتیوم هوا عملی توجه دقیق لازم است. برای جلوگیری از مسائل مربوط به پایداری مربوط به کربن، در کار خود با DMSO، پنگ و همکاران از طلای نانو متخلخل به عنوان زیرلایه جایگزین در باتریهای لیتیوم هوا استفاده کرند.
اگرچه طلا تقریباً ۱۰ برابر سنگینتر از الکترود کربن است و به دلیل هزینه بالا برای استفاده عملی مناسب نیست اما پس از ۱۰۰ چرخه پایداری ۹۵٪ ظرفیت را نشان میدهد. در نتیجه اخیرا جستجوی الکترودهای بدون کربن به طور فعال دنبال شده است.
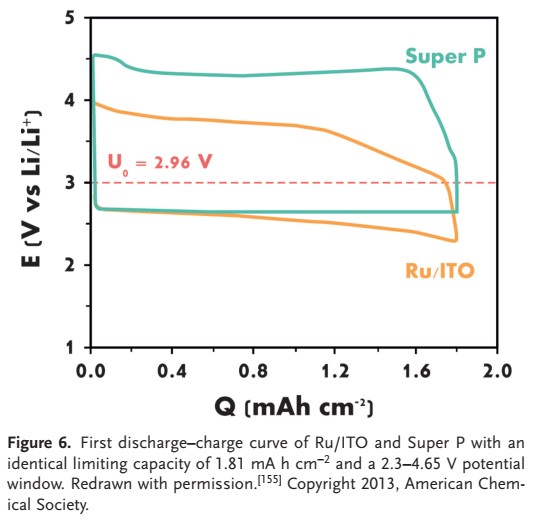
لی و همکارانش از نانوذرات روتنیم اکسید قلع ایندیوم (Ru/ITO) به عنوان الکترود بدون کربن در باتری لیتیوم هوا استفاده کردند. الکترود Ru/ITO پتانسیل اضافی بسیار پایینتر و رفتار چرخهای بهتری نسبت به الکترود Super P (SP) و الکترود SP پوشش داده شده با نانوذرات Ru (Ru/SP) را نشان داد، که در شکل ۶ نشان داده شده است.
با توجه به فقدان پاسخ قطعی، ضرورت و اثرات جانبی الکترودهای کربنی هنوز مورد بحث است. با توجه به سهم وزن منفی اکسیدهای فلزی پیشنهادی، هنوز مشخص نیست که آیا الکترودهای فاقد کربن عملا قابل اجرا هستند یا خیر. مطالعات موازی روی الکترودهای پیشرفته فاقد کربن و راههای جلوگیری از اثرات جانبی کربن باید در این مرحله انجام شود.
۲٫۳٫۳٫ کاتالیزورها
اگرچه بسیاری از الکترودهای کربنی فعالیت ORR کاتالیزوری را نشان دادهاند اما فعالیت کاتالیزوری نسبتاً کم کربن در OER استفاده از کاتالیزورهای اضافی را برای تجزیه برگشت پذیر Li2O2 تشویق کرده است، برخی از آنها برای واکنش در هر دو مورد استفاده قرار گرفته است. در حالی که استفاده از کاتالیزورها میتواند سینتیک واکنش باتری های لیتیوم هوا را افزایش دهد (افزایش ظرفیت، کاهش پتانسیل درطول چرخه تخلیه – شارژ و بهبود قابلیت سرعت)، هنوز مشخص نیست که آیا کاتالیزور عملکرد کلی را به دلیل مشکل احتمالی تجزیه الکترولیتها، هم در الکترولیتهای برپایه اتر و هم بر پایه کربنات اتفاق میافتد، را بهبود میبخشد یا خیر.
برخی مطالعات استدلال میکنند که این واکنشهای تشکیل و تجزیه Li2O2 نیستند که در طول فرآیندهای تخلیه و شارژ کاتالیز میشوند، بلکه تشکیل – تجزیه Li2CO3 و تجزیه الکترولیتها هستند. با این وجود، الکتروکاتالیستهای موثر زیادی در حال حاضر در باتریهای غیر آبی لیتیوم هوا مورد استفاده قرار میگیرند که برجستهترین آنها در جدول ۲ خلاصه شده است.
استفاده از واسطه های محلول یا “شاتلهای اکسایش-کاهش” نیز اخیرا برای واسطه انتقال الکترون در طول ORR ، OER یا هر دو پیشنهاد شده است. در مورد واسطه های ORR، یک مزیت آشکار این است که واسطه محلول در الکترود کاهش یافته و سپس نفوذ میکند، با مسدود کردن شکل گیری Li2O2 از مسدود شدن منافذ جلوگیری میکند.
علاوه بر این، فاصله نفوذ برای O2 کوتاه میشود زیرا احیای O2 به سطح الکترولیت نزدیک میشود (به شرطی که شاتل سریعتر از O2 نفوذ کند). مزیت واسطههای OER افزایش قابلیت شارژ و نرخ واکنش است، زیرا Li2O2 به راحتی توسط واسطه محلول قابل دسترسی است.
با این حال، استفاده از شاتلهای اکسایش-کاهش میتواند منجر به “شاتل” پارازیت بین دو الکترود همراه با تخلیه شود. بنابراین این رویکرد نویدبخش هنوز نیاز به مطالعه بیشتری نیز از نظر مهندسی پیل دارد.
۲٫۳٫۴٫ اکسیدهای فلزی
تا به امروز، اکسیدهای فلزی کاتالیزورهای ترجیحی برای ORR و OER بودهاند. اکسید منگنز، به ویژه به دلیل فعالیت مناسب ORR بر اساس ظرفیت ویژه بالا و هزینه کم مورد توجه بسیاری قرار گرفته است. بروس و همکارانش اثربخشی ساختارهای کریستالی مختلف اکسید منگنز را مقایسه کردند و α-MnO2 را به عنوان بهترین اثر کاتالیزوری برای تجزیه اکسیژن و هماهنگی یون لیتیوم گزارش کردند.
علاوه بر این، آن ها خواص کاتالیزوری نانوسیم α-MnO2 را برتر از خواص کروی MnO2 دانستند، که مورد دوم قابل مقایسه با زیرلایه کربن متخلخل است. با این حال، باید در مورد رفتار کاتالیزوری ساختارهای مختلف MnO2 بسیار محتاط بود، زیرا اکثر مطالعات در حضور الکترولیت های برپایه PC انجام شده است که اکنون برای تجزیه شناخته شده است.
در بسیاری از گزارشها استفاده از سایر اکسیدهای فلزی به عنوان کاتالیزور در باتریهای لیتیوم هوا (به عنوان مثال، اکسید کبالت، اکسید مس، اکسید آهن، اکسید پالادیوم و سایر موارد مورد بحث قرار گرفته است. اخیرا اکسید روتنیوم و اکسید ایریدیوم به دلیل توانایی کاتالیزاسیون عالی OER در ترکیب با کربن یا سایر مواد زیرلایه مورد توجه قرار گرفتهاند.
۲٫۳٫۵٫فلزات
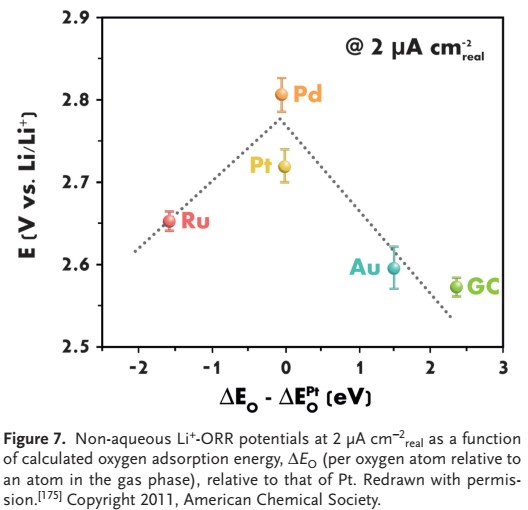
از آنجایی که لو و همکاران خواص کاتالیزوری برتر نانوذرات پلاتین-طلا را نشان دادند (Pt 0.5 Au 0.5 پوشش داده شده روی Vulcan carbon XC-72)، استفاده از کاتالیزورهای فلز نجیب در باتریهای لیتیوم هوا به میزان قابل توجهی افزایش یافته است. گروه یکسان فعالیت ORR پالادیوم، پلاتین، روتنیوم و طلا را بررسی کردند و نتایج را با نتایج بدست آمده با کربن شیشه ای (GC) مقایسه کردند.
فعالیت ORR به ترتیب کاهش یافت: Pd> Pt> Ru ≈ Au> GC، همانطور که در شکل ۷ نشان داده شده است. روند مشاهده شده با منحنیهای پلاریزاسیون ORR به دست آمده با الکترود دیسک چرخان و با پتانسیل اضافی تخلیه مشاهده شده در پیلهای لیتیوم هوا مطابقت داشت. پالادیوم و پلاتین به دلیل اثرات کاتالیزوری فوق العاده ORR، به صورت خالص یا همراه با سایر کاتالیزورها (فلزات یا اکسیدهای فلز) برای کاتالیستها انتخاب ترجیحی بودهاند. اخیرا در راستای تلاش برای جلوگیری از تجزیه الکترولیتها در سطح کربن، لو و همکاران از کاتالیزور متشکل از نانوذرات پالادیوم بر روی سطح کربن که تا حدی با آلومین پوشانده شده است استفاده کردند تا مکانهای نقص کربن را غیرفعال کند.
کاتالیزورهای فلزات غیر گرانبها نیز مورد مطالعه قرار گرفتهاند. رن و همکاران کاتالیزورهای فلزی Cu -Fe را روی کربن سیاه Ketjen آزمایش کردند و خاطرنشان کردند که این کاتالیزورها یک اثر کاتالیزوری ORR با افزایش معنیدار ولتاژ تخلیه و بهبود نرخ طرفیت نشان دادند.
با این حال، فقط اثر کاتالیزوری ORR تحلیل شد، بدون اینکه عملکرد در طول شارژ تعیین شود. علاوه بر این مثالها، مطالعات زیادی در مورد استفاده از کاتالیزورهای فلزی در باتریهای لیتیوم هوا انجام شده است. هنوز مطالعات بیشتری برای یافتن راههای مناسب برای ایجاد کاتالیزورهای پایدار و انتخابی برای واکنشهای مورد نیاز است.
۳٫ دیدگاه فناوری
محققانی که روی باتری لیتیوم هوا کار میکنند نمیتوانند از نتیجه نهایی کار خود، یعنی توسعه یک شیمی پایدار و کاربردی برای کاربردهای خودرو چشم پوشی کنند. بنابراین هدف اصلی در تحقیقات کنونی در مورد باتری های لیتیوم هوا، توسعه فناوری ذخیره انرژی الکتروشیمیایی است که دارای چگالی توان قابل مقایسه با باتریهای یون-لیتیم و انرژی مشخصی نزدیک به بنزین مخزن به چرخ است.
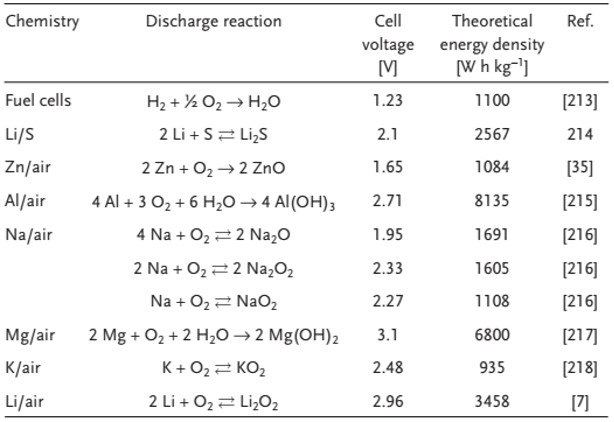
بنابراین، ارزیابی این که آیا زوج Li/O2 میتوانند به این هدف برسند، مهم است یا باید تحقیقاتی در زمینه فناوریهای دیگر در این زمینه انجام شود و سایر کاربردها برای “جام مقدس” باتریها، یعنی لیتیوم هوا در نظر گرفته شود. با در نظر گرفتن دیدگاه مشابه، سایر شیمی و فناوریهای ذخیره سازی پیلها، مانند پیلهای سوختی و باتریهای لیتیوم گوگرد و فلز هوا، به دلیل چگالی انرژی نظری به همان اندازه جذاب مورد بررسی قرار میگیرند (جدول ۳).
جدول ۳ خلاصه ای از سلول های جایگزین لیتیوم-هوا برای خودروهای برقی
۳٫۱ انرژی ویژه نظری و عملی
غالبا با شوق و اشتیاق گفته میشود که سوزاندن لیتیوم میتواند یک وات ساعت بر کیلوگرم، مقدار مشابهی از انرژی خاص را برای بنزین (به ترتیب ۱۱۶۸۰ وات ساعت بر کیلوگرم در مقابل ۱۳ هزار وات ساعت بر کیلوگرم ) را فراهم کند. از آنجایی که موتورهای احتراق داخلی بسیار ناکارآمد هستند، زیرا کمتر از ۱۵ درصد از انرژی بنزین به پیشرانه خودرو میرسد، این امر منجر به رقم قابل ذکر قبلا۱۷۵۰وات ساعت بر کیلوگرم برای سوخت معمولی میرسد.
از سوی دیگر، موتورهای الکتریکی میتوانند دارای بازده انرژی معمولی %۹۰ باشند، به این معنی که یک باتری لیتیوم هوا به صورت تئوری میتواند تا حد زیادی از یک موتور بنزینی بیشتر عمل کند. با این حال، محاسبات کمی پیچیدهتر است، همانطور که کریستنسن و همکارانش خلاصه کردهاند قبل از هر چیزی، با نگاه کردن به کاتد، نمیتوان از الکترود Li2O2 عایق کاملا استفاده کرد، بنابراین باید یک نگه دارنده رسانا، همراه با اتصال دهنده و اکسیژن مصرفی در هنگام تخلیه، در نظر گرفته شود.
در مرحله دوم، یک غشاء انتخابی O2 نیز باید اضافه شود تا اطمینان حاصل شود که هیچ آلایندهای وارد سلول نمیشود. ویژگیهای اصلی مورد اخیر عبارتند از: ۱) نفوذ پذیری بالا برای O2 ۲) انسداد بخار آب و CO2، و ۳) کنترل الکترولیت در سلول.
پس از افزودن الکترولیت، منبع O2 و اجزای غیر فعال، این مقدار به سرعت به حدود ۱۰۰۰ وات ساعت بر کیلوگرم کاهش مییابد، که به طور قطع در مقایسه با یون لیتیوم پیشرفته و احتمالی در آینده باتریها یون-لیتیم (به ترتیب ۱۵۰ و ۲۵۰ وات ساعت بر کیلوگرم) بهبود چشمگیری دارد، اما هنوز هم کمتر از بنزین هستند.
برای پیچیدهتر شدن کار، باتریهای لیتیوم هوا باز دارای ویژگی افزایش وزن و کاهش حجم با ادامه تخلیه هستند، بنابراین دو مقدار میتواند تغییرات حجم برای یک سلول عملی می تواند تا ۳۰ باشد، زیرا پراکسید لیتیوم بیش از چهار برابر وزن ویژه فلز لیتیوم است. خوشبختانه این اشکالات را میتوان تا حدی جبران کرد اندازه کوچکتر موتورهای الکتریکی (BMW i3 دارای موتور ۶۵۰ سی سی است).
در مورد نیاز به جداسازی O2 از اجزای ناخواسته در هوا، این امر در حال حاضر تنها با غشاهای متخلخل و در عین حال جریان هوای خشک کم امکان پذیر است.
کروتر و همکاران تحقیق کردند عملکرد غشاهای انتخاب کننده اکسیژن در باتری های لیتیوم هوا آنها از سلول با استفاده از تفلون روی پارچه شیشهای روکش دار (TCFC) در قسمت بیرونی تکیه گاه کاتد محافظت کردند و در نتیجه از فراریت الکترولیت و اکسیداسیون فلز لیتیوم توسط H2O جلوگیری کردند.
به منظور نگه داشتن پیل تحت فشار ثابت، وزن و حجم کمپرسور گاز را باید در نظر گرفت. برای یک سیستم باز، عملکرد آن بیشتر عملکرد جمع آوری O2 و ایجاد فشار کافی در داخل پیل در طول عملکرد است، اما چنین دستگاهی همچنین می تواند به انرژی ویژه بسته کمک منفی کند. این گمانه زنی وجود دارد که آیا غشاها باید به نفع افزودن مخزن O2 برای اهداف عملی رها شوند.
این امر به طور قطع مشکلات ناشی از جمع آوری O2 به عنوان مثال فیلتراسیون و تصفیه، همراه با شار بالا برای استفاده از خودرو را حل میکند، اما بستن سیستم به محیط خارجی نگرانیهای ایمنی را افزایش میدهد (O2 باید در فشارهای زیاد ذخیره شود) و انرژی ویژه عملی را کاهش دهید.
سرانجام، در سمت آند، بازده بار پایین که معمولا توسط الکترودهای فلزی لیتیوم نشان داده میشود، نشان میدهد که این ماده باید بیش از حد به پیل اضافه شود و باعث کاهش بیشتر چگالی انرژی حجمی میشود. با در نظر گرفتن این پارامترها و محدودیتها، انتظار میرود مقادیر هدف در حدود ۵۰۰ وات ساعت بر کیلوگرم و ۵۷۰ وات ساعت بر لیتر توسط پیلهای غیر آبی حتی اگر شامل یک مخزن O2 باشد، برآورده شود، در حالی که پیلهای آبی ممکن است از علیرغم ولتاژ عملیاتی بالاتر، به چنین الزاماتی دستیابی نداشته باشد.
۳٫۲ الزامات خودروهای برقی
با درنظر گرفتن پارامترهای عملی، اکنون میتوان تخمین زد که یک باتری فرضی لیتیوم هوا در خودروهای برقی (EV) چگونه خواهد بود. به شرط دستیابی به چگالی انرژی بالا، اولین عامل شایستگی محدوده رانندگی خواهد بود. “اضطراب رانندگی” احساسی است که وقتی راننده در نشانگر سوخت به پایین میرسد به رانندگان القا میشود، اگرچه معمولا خودروهای بنزینی هنوز سوخت کافی برای رانندگی ۱۰۰ کیلومتر دیگر پس از این مرحله را ندارند.
این مقدار در حال حاضر با حداکثر برد رانندگی اکثر وسایل نقلیه یون-لیتیم مطابقت دارد. بنابراین، میزان انرژی بسته باتری باید حداقل تا یک فاکتور از ۵ افزایش یابد. با ۱۴۰ کیلو وات ساعت و انرژی ویژه ۵۰۰ وات ساعت بر کیلوگرم، منطقی است که انتظار یک بسته باتری غیر آبی که بیش از ۳۰۰ کیلوگرم وزن ندارد و با لوازم جانبی حداقل ۵۰۰ کیلومتر رانندگی میکند.
از نظر حجمی، این مقدار به ۲۵۰ لیتر حدود میرسد که بسیار کمتر از ظرفیت صندوق عقب و مخزن یک خودرو معمولی شهری است. حتی اگر یک مخزن O2 اضافه شود، محدودیت حجم زیاد نخواهد بود. با این حال، رسیدن به ۵۰۰ وات ساعت بر کیلوگرم در سطح بسته بیاهمیت نیست، زیرا فرض بر ۳ آمپر ساعت بر گرم از زیرلایه کربن و ولتاژ تخلیه ۲٫۷ ولت منجر به حداکثر انرژی ویژه ۲ کیلووات ساعت بر کیلوگرم مربوط به زیرلایههای لیتیوم و کربن میشود. از این رو، اجزای غیرفعال سلول (لایه انتشار گاز (GDL) ، صفحه ورودی و غیره) و دستگاههایی که قادر به تأمین مقدار بالای O2 هستند نباید بیش از ۷۵ درصد وزن بسته را شامل شوند.
در مورد چگالی توان، اولین قدم برای اطمینان از سینتیک سریع، ایجاد یک مرز سه فاز در داخل منافذ کاتد است ، جایی که O2 ، الکترولیت و زیرلایه کربن در مقیاس نانو در کنار هم وجود دارند.
به عنوان مثال، اگر تمام تخلخل در تکیه گاه با الکترولیت پر شود، سرعت واکنش با حلالیت کم O2 در حلال محدود میشود و عمق تخلیه را به شدت مختل می کند. از طرف دیگر، اگر حلالیت O2 به اندازه کافی بالا باشد، پیکربندی “سیل” مفید خواهد بود، زیرا رسوب محصولات تخلیه همگن بوده و محدود به رابط مرزی سه فاز نیست.
با این حال ، برخلاف باتریهای یون-لیتیم و پلیمر فلز-لیتیم، که عمدتاً شامل الکترولیت، جداکننده، جمع کننده جریان و بسته بندی به عنوان اجزای غیرفعال در سطح پشته هستند، جریان O2 مورد نیاز برای استفاده در برنامههای خودرو به معنی اضافی است وزن در سطح سلول در واقع ، برد ۵۰۰ کیلومتر به معنای زمان تخلیه ۵ ساعت، مربوط به مصرف ۹۶۷ مول O2 است. این مقدار برابر با شار O2 حدود ۱٫۲ لیتر بر ثانیه است که اگر تمام O2 مصرف شود.
با این حال، اگر در نظر بگیریم که اکسیژن تنها حدود یک پنجم جو زمین را تشکیل می دهد و برداشت موثر آن میتواند کمتر ۲۰ باشد. انتظار میرود که جریانهای بسیار بیشتری نیاز باشد. به همین دلیل، هر پیل نیاز به بار اضافی به شکل یک صفحه میدان-جریان دارد تا O2 را به زیرلایه کاتد تغذیه کند، همانطور که قبلا در مورد پیلهای سوختی اینطور بود.
در حالی که راه حل برای دسته دوم واقع بینانه است، جایی که تخلیه محصول واکنش (H2O) ازپیل ظرفیت نامحدودی در سطح سطح پیل ایجاد میکند، این امر در مورد باتریهای لیتیوم هوا صادق نیست، زیرا ظرفیت توسط وزن هر دو زرلایه لیتیم و رسوب Li2O2 محدود شده است.
باتریهای لیتیوم هوا برای محلولهای خودرو به مواد غیرفعال سبک و همچنین الکترودهایی با ضخامت در محدوده میلی متر و بر این اساس چگالی جریان در محدوده ۱ تا ۱۰ میلی آمپر سانتی متر بر متر مربع نیاز دارند. بنابراین، بعید است که یک باتری لیتیوم هوا که در حالت “تنفس” کار میکند (یعنی از طریق نفوذ O2 ساده از طریق غشاهای آبگریز پرفورئور تغذیه میشود)، بتواند به هرگونه قدرت قابل توجه دست یابد. در سطح مهندسی، برخی از راه حلهای میان مدت را میتوان در نظر گرفت: چگالیهای جریان کوچک برای سرعت حرکت قابل قبول هستند و کاستیهای حداکثر بار را میتوان با افزودن یک بسته کوچک ابرخازن یون-لیتیم در کنارلیتیم هوا اصلی برطرف کرد.
قطار قدرت، همانطور که قبلاً برای پیلهای سوختی پیشنهاد شده است. در هر صورت، چنین بهبودی در چگالی جریان ممکن است برای هماهنگی با افزایش حجم باتری کافی نباشد. باتریهای لیتیوم یونی نسبت به بنزین و پیلهای سوختی از نظر زمان شارژ (سوخت گیری) عقب هستند، با افزایش پنج برابری ظرفیت، شارژ یک شبه برای پر کردن باتری کافی نخواهد بود. اگر چگالیهای جریان بیشتر به طور پیوسته به دست نیامد، توسعه زیرساختهای زیاد از نظر ایستگاههای شارژ سریع هنوز مشکل را حل نمیکند.
آخرین نگرانی که در نهایت میزان ماندگاری یک وسیله برقی لیتیم هوا را تعیین میکند، ایمنی است. وجود یک آند فلزی لیتیوم قطعا اولین جنبهای است که به ذهن میرسد زیرا رسوبات دندریتیک میتواند در سطح فلز ایجاد شود، از میان جدا کننده رشد کرده و در نهایت یک اتصال کوتاه در سلول ایجاد کند. اگر دندریتها به اندازه کافی کوچک باشند و با جریانهای موضعی زیاد آنها را از نظر الکتروشیمیایی غیرفعال کند، این خطر اغلب اغراق آمیز است.
همچنین، استفاده از الکترولیتهای پلیمری جامد شروع دندریتها را به تاخیر انداخته است. خطر دیگر مربوط به حمل و نقل اکسیژن در پیل است: اگر یک مخزن O2 روی پیل ذخیره شده شود، برای جلوگیری از ایجاد فشار باید سیستمهای تهویه را طراحی کرد. همچنین، در حالی که مواد انتخاب شده برای مخزن تا حد ممکن سبک هستند، باید چندین صد بار را تحمل کنند.











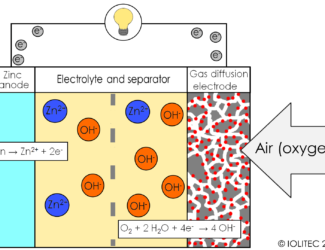


1 دیدگاه
[…] باتری لیتیم هوا […]